Descubre la fascinante explicación del modelo de Rutherford que cambiará tu visión de la estructura del átomo
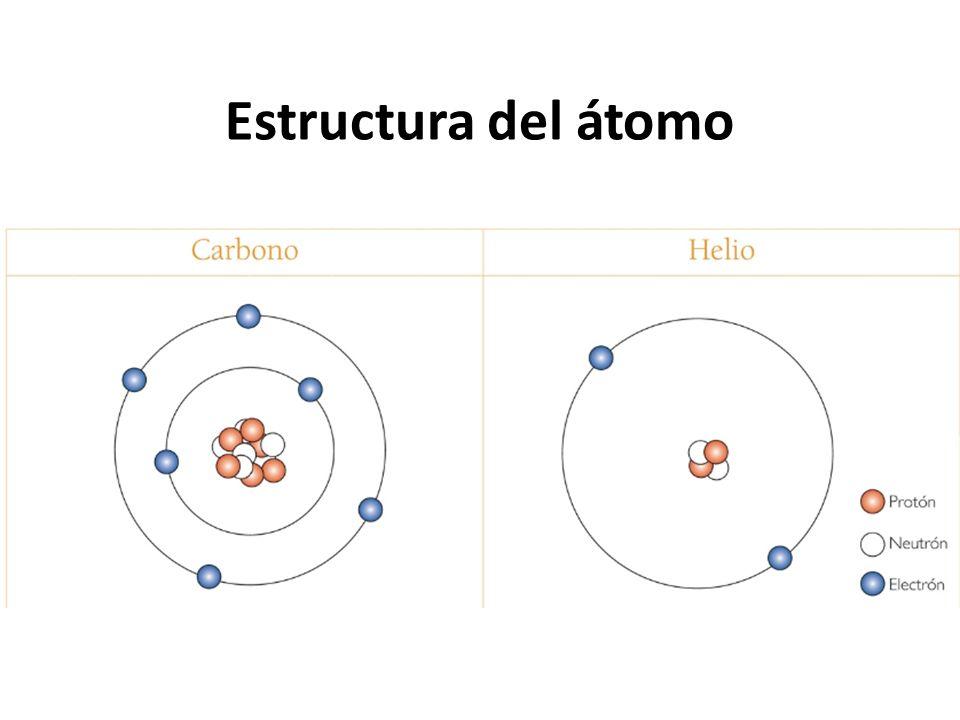
El modelo de Rutherford es uno de los hitos más importantes en el estudio de la estructura del átomo. Fue propuesto por el físico británico Ernest Rutherford en 1911, y supuso una revolución en nuestra comprensión de la forma en que los electrones y los núcleos interactúan dentro de un átomo. Este modelo sentó las bases para el desarrollo posterior de la teoría cuántica y ayudó a establecer la química moderna.
Exploraremos en detalle el modelo de Rutherford y su explicación de la estructura atómica. Analizaremos cómo Rutherford llegó a su modelo mediante experimentos con partículas alfa, y cómo esta teoría rompió con la visión previa del átomo como una esfera homogénea y sólida. También abordaremos las limitaciones del modelo de Rutherford y cómo su trabajo allanó el camino para futuros avances en física y química.
- Qué es el modelo de Rutherford y por qué es importante
- Cuál fue el experimento que llevó a Rutherford a desarrollar su modelo
- Cuáles eran las explicaciones anteriores sobre la estructura del átomo
- Cuál fue la principal contribución de Rutherford al modelo atómico
- En qué consiste el experimento de la lámina de oro y cómo apoya el modelo de Rutherford
- Cómo describe el modelo de Rutherford la distribución de cargas en el átomo
- Por qué el modelo de Rutherford fue revolucionario en su tiempo
- Cuáles son las limitaciones del modelo de Rutherford
- Cómo ha evolucionado el modelo atómico desde los tiempos de Rutherford
- ¿Qué impacto ha tenido el modelo de Rutherford en la comprensión actual de la física? Estos son solo algunos de los temas que se pueden abordar al explorar la fascinante explicación del modelo de Rutherford y su influencia en nuestra comprensión de la estructura del átomo. Hay muchas más preguntas y aspectos interesantes que descubrir en este tema tan importante para la ciencia.
- Preguntas frecuentes (FAQ)
Qué es el modelo de Rutherford y por qué es importante
El modelo de Rutherford, también conocido como el modelo planetario del átomo, fue propuesto por el físico neozelandés Ernest Rutherford en 1911. Este modelo revolucionó nuestra comprensión de la estructura del átomo al desafiar las teorías previas y proporcionar una explicación más precisa de cómo se distribuyen los electrones dentro de un átomo.
Antes del modelo de Rutherford, se creía que los electrones estaban dispersos en forma uniforme alrededor del núcleo del átomo. Sin embargo, mediante experimentos realizados en su famoso laboratorio de la Universidad de Manchester, Rutherford descubrió que esta teoría no podía ser correcta.
El experimento clave que llevó a Rutherford a su nuevo modelo fue el famoso experimento de la lámina de oro. En este experimento, Rutherford bombardeó una fina lámina de oro con partículas alfa (núcleos de helio) y observó cómo se dispersaban las partículas al chocar con los átomos de oro.
El resultado sorprendente fue que la mayoría de las partículas alfa atravesaban la lámina de oro sin desviarse significativamente, pero unas pocas eran desviadas en ángulos inesperados. Esto llevó a Rutherford a concluir que la mayor parte del átomo es espacio vacío, excepto por una pequeña región central muy densa a la que llamó "núcleo".
Según el modelo de Rutherford, los electrones giran alrededor del núcleo en órbitas circulares o elípticas, al igual que los planetas giran alrededor del sol. Además, postuló que los electrones tienen carga negativa y que la carga positiva se encuentra en el núcleo, lo que resulta en una atracción electrostática para mantener a los electrones en su lugar.
Este nuevo modelo fue revolucionario porque proporcionó una imagen más realista de la estructura del átomo, explicando de manera efectiva dónde se encuentran los electrones y cómo interactúan con el núcleo. Este avance fue fundamental para el desarrollo posterior de la física nuclear y la comprensión de las propiedades de los elementos químicos.
Cuál fue el experimento que llevó a Rutherford a desarrollar su modelo
El modelo de Rutherford, también conocido como el modelo planetario del átomo, fue desarrollado por el físico neozelandés Ernest Rutherford en 1911. Este modelo se basó en los resultados de un experimento conocido como el experimento de la lámina de oro.
En este experimento, Rutherford y su equipo dispararon partículas alfa (núcleos de helio) a una lámina de oro extremadamente delgada. Esperaban que las partículas alfa atravesaran la lámina sin ningún desvío significativo, ya que según el modelo atómico aceptado en ese momento, el modelo de Thomson, se creía que los electrones estaban distribuidos homogéneamente alrededor del núcleo del átomo.
Sin embargo, los resultados del experimento sorprendieron a Rutherford. Descubrió que la mayoría de las partículas alfa pasaban directamente a través de la lámina de oro sin ninguna desviación, pero unas pocas partículas eran desviadas de manera significativa e incluso algunas rebotaban hacia atrás. Esto fue algo inesperado, ya que contradecía las predicciones del modelo de Thomson.
La interpretación de los resultados
Rutherford interpretó los resultados del experimento de la siguiente manera: si la mayoría de las partículas alfa atravesaba la lámina de oro con poca o ninguna desviación, esto significa que la mayor parte del átomo es espacio vacío. Si solo unas pocas partículas eran desviadas o rebotaban, esto indicaba que había una región central densa y cargada positivamente en el átomo.
Basándose en estos resultados, Rutherford propuso un modelo en el que los electrones giran alrededor de un núcleo central pequeño y denso. Este núcleo contenía la mayor parte de la masa del átomo y tenía una carga positiva considerable, mientras que los electrones tenían una carga negativa y se encontraban distribuidos en órbitas alrededor del núcleo.
Las implicaciones del modelo de Rutherford
El modelo de Rutherford revolucionó nuestra comprensión de la estructura atómica. Antes de este experimento, se creía que el átomo era indivisible y que los electrones estaban distribuidos uniformemente en su interior. Sin embargo, Rutherford demostró que el átomo tiene una estructura mucho más compleja y que contiene una región central densa y cargada positivamente: el núcleo.
Esto condujo a la formulación del modelo planetario del átomo, donde los electrones giran alrededor del núcleo en órbitas definidas. Aunque este modelo fue reemplazado posteriormente por el modelo cuántico, el modelo de Rutherford sentó las bases para nuestro entendimiento actual de la estructura atómica.
Cuáles eran las explicaciones anteriores sobre la estructura del átomo
Antes de que el modelo de Rutherford fuera propuesto, se tenían diferentes explicaciones sobre la estructura del átomo. Estas teorías anteriores intentaban dar respuesta a preguntas como "¿De qué está hecho el átomo?" y "¿Cómo se organizan sus componentes?". A continuación, exploraremos brevemente algunas de las teorías más influyentes previas al modelo de Rutherford:
Modelo atómico de Dalton
El modelo atómico propuesto por John Dalton en el siglo XIX fue uno de los primeros intentos de explicar la estructura interna del átomo. Según Dalton, el átomo era una partícula indivisible y uniforme, sin embargo, esta idea posteriormente se demostró como incorrecta.
Modelo atómico de Thomson
Después del modelo de Dalton, Joseph John Thomson propuso un nuevo modelo atómico conocido como el modelo del pudín de pasas. Este modelo sugiere que el átomo es una esfera positiva con electrones incrustados dentro de ella, similar a las pasas en un pudín. Esta teoría introdujo el concepto de partículas subatómicas y llevó al descubrimiento del electrón.
Modelo atómico de Rutherford
A pesar de los avances proporcionados por el modelo de Thomson, aún quedaban muchas preguntas sin respuesta. Fue entonces cuando Ernest Rutherford realizó su famoso experimento de dispersión de partículas alfa para investigar la estructura del átomo. Este experimento involucraba disparar partículas alfa hacia una delgada lámina de oro y observar cómo se dispersaban.
Basándose en los resultados de este experimento, Rutherford propuso un nuevo modelo atómico. Según su teoría, el átomo consiste en un núcleo central pequeño y denso cargado positivamente, donde reside la mayor parte de la masa del átomo. Alrededor del núcleo, los electrones giran en órbitas circulares, similares a planetas alrededor del sol.
Este modelo descartaba la idea de que el átomo era una esfera uniformemente distribuida y planteaba la existencia de un núcleo y electrones externos. Fue un avance significativo en nuestra comprensión de la estructura del átomo.
Aunque el modelo de Rutherford era una mejora con respecto a las teorías anteriores, se encontró con algunas limitaciones posteriores, lo que llevó al desarrollo de modelos más sofisticados como el modelo de Bohr y el modelo cuántico.
Cuál fue la principal contribución de Rutherford al modelo atómico
El modelo atómico propuesto por Ernest Rutherford en 1911 revolucionó nuestra comprensión de la estructura del átomo. Antes de su descubrimiento, se creía ampliamente que el átomo era una esfera homogénea y compacta. Sin embargo, los experimentos realizados por Rutherford en el laboratorio demostraron que esto no era cierto.
La principal contribución de Rutherford fue su experimento conocido como la prueba de dispersión de partículas alfa. En este experimento, Rutherford bombardeó una fina lámina de oro con partículas alfa, que son núcleos de helio cargados positivamente. Esperaba que las partículas alfa pasaran a través de la lámina sin desviarse significativamente, de acuerdo con la teoría dominante en ese momento.
Sin embargo, los resultados del experimento fueron sorprendentes. Un pequeño número de partículas alfa rebotaron hacia atrás o desviadas a ángulos muy grandes, lo cual era completamente inesperado. Rutherford interpretó estos resultados como evidencia de que la mayor parte del átomo está vacía y que toda la carga positiva y masa se concentran en un núcleo muy pequeño y denso en el centro del átomo.
Esta idea revolucionaria llevó a la formulación del modelo atómico de Rutherford, también conocido como el modelo planetario. Según este modelo, el átomo consiste en un núcleo central positivo rodeado por electrones que orbitan a su alrededor, al igual que los planetas giran alrededor del sol en el sistema solar.
El modelo de Rutherford fue un gran avance en nuestra comprensión de la estructura del átomo y sentó las bases para desarrollos posteriores en la teoría cuántica y la física nuclear. Aunque posteriormente se demostró que el modelo de Rutherford tenía algunas limitaciones, su contribución al campo de la física es innegable y sigue siendo estudiada y enseñada en todo el mundo hoy en día.
En qué consiste el experimento de la lámina de oro y cómo apoya el modelo de Rutherford
El experimento de la lámina de oro, también conocido como el experimento de Rutherford, fue un hito en el estudio de la estructura del átomo y proporcionó evidencia sólida para respaldar el modelo propuesto por Ernest Rutherford.
En este experimento, Rutherford y su equipo bombardearon una fina lámina de oro con partículas alfa, que son núcleos de helio compuestos por dos protones y dos neutrones. Estas partículas alfa fueron emitidas por una fuente radiactiva colocada en un dispositivo especialmente diseñado llamado "cañón de partículas".
Rutherford esperaba que las partículas alfa simplemente atravesaran la lámina de oro sin desviarse en ninguna dirección significativa, ya que de acuerdo con el modelo de Thomson, en ese momento ampliamente aceptado, se pensaba que los átomos eran una especie de "budín" con carga positiva uniformemente distribuida y los electrones incrustados en ella.
Sin embargo, los resultados obtenidos fueron sorprendentes y contrarios a las expectativas de Rutherford. La mayoría de las partículas alfa pasaron directamente a través de la lámina de oro sin desviarse, pero algunas de ellas experimentaron una desviación muy grande y unas pocas incluso rebotaron hacia atrás.
Esta observación inesperada llevó a Rutherford a concluir que la mayor parte del átomo es espacio vacío y que la carga positiva y casi toda la masa se concentran en un núcleo denso ubicado en el centro del átomo. También dedujo que los electrones orbitan alrededor de este núcleo en órbitas circulares o elípticas.
Estos resultados fueron fundamentales para la formulación del modelo de Rutherford, también conocido como el modelo planetario del átomo. Según este modelo, el átomo tiene un núcleo pequeño y denso en el centro, con electrones girando alrededor de él en órbitas específicas.
A pesar de que el modelo de Rutherford tenía algunas limitaciones y se modificó posteriormente con el descubrimiento de la mecánica cuántica, el experimento de la lámina de oro proporcionó una base sólida para la comprensión de la estructura atómica y sentó las bases para futuros descubrimientos en el campo de la física nuclear.
Cómo describe el modelo de Rutherford la distribución de cargas en el átomo
El modelo de Rutherford es una teoría que describe la distribución de cargas en el átomo. Propuesto por Ernest Rutherford en 1911, este modelo fue resultado del famoso experimento de la lámina de oro realizado en su laboratorio en Manchester.
Según el modelo de Rutherford, el átomo está compuesto por un núcleo central positivo y una corteza externa negativa. El núcleo, que representa la mayor parte de la masa del átomo, contiene protones con carga positiva. Estos protones están agrupados en el centro del átomo, creando una carga positiva concentrada en una región pequeña.
Alrededor del núcleo, se encuentran los electrones, partículas subatómicas con carga negativa. Estos electrones orbitan alrededor del núcleo en diferentes capas o niveles de energía. Cada nivel de energía puede alojar una cierta cantidad de electrones, y estos niveles se representan como órbitas elípticas o circulares alrededor del núcleo.
La principal contribución del modelo de Rutherford fue su explicación de la forma en que las cargas están distribuidas en el átomo. Antes de este modelo, se pensaba que las cargas positivas y negativas estaban mezcladas de manera uniforme en todo el átomo. Sin embargo, a través de su experimento con la lámina de oro, Rutherford demostró que la mayor parte de la masa y la carga positiva del átomo están concentradas en el núcleo.
En su experimento, Rutherford disparó partículas alfa (núcleos de helio) hacia una lámina de oro muy delgada. La mayoría de las partículas atravesaron la lámina sin ser desviadas, lo que indicaba que el átomo es mayoritivamente espacios vacíos. Sin embargo, algunas partículas fueron desviadas o rebotadas en ángulos inesperados. Rutherford explicó esto como resultado de la interacción entre las partículas alfa y el núcleo del átomo, indicando que debía haber una carga positiva concentrada en un espacio muy pequeño dentro del átomo.
Por lo tanto, según el modelo de Rutherford, los electrones giran alrededor del núcleo en órbitas elípticas o circulares, creando una distribución de cargas en el átomo que está dominado por la carga positiva del núcleo. Esta explicación revolucionó nuestra comprensión de la estructura atómica y sentó las bases para desarrollos posteriores en la teoría cuántica y la mecánica cuántica.
Por qué el modelo de Rutherford fue revolucionario en su tiempo
El modelo de Rutherford, propuesto por el físico neozelandés Ernest Rutherford en 1911, fue revolucionario en su tiempo porque desafiaba la concepción anteriormente aceptada de la estructura del átomo.
Antes del modelo de Rutherford, se creía que los átomos eran una especie de "budines" homogéneos y uniformes, es decir, sin ninguna estructura interna definida. Sin embargo, los experimentos realizados por Rutherford en ese momento demostraron que esta teoría era insuficiente para explicar ciertos fenómenos observados.
En sus experimentos, Rutherford utilizó partículas alfa (núcleos de helio) para bombardear láminas delgadas de oro. Según el modelo plum pudding propuesto por J.J. Thomson, se esperaba que las partículas alfa simplemente pasaran a través del átomo sin desviarse significativamente.
Sin embargo, los resultados experimentales de Rutherford fueron sorprendentes: descubrió que algunas partículas alfa eran desviadas bruscamente por ángulos inesperados, e incluso algunas rebotaban hacia atrás. Este hallazgo sugería que había una estructura interna mucho más compleja en el átomo de la que se creía anteriormente.
Rutherford concluyó que la desviación y el rebote de las partículas alfa solo podían explicarse si se asumía que la mayor parte de la masa y carga positiva del átomo estaban concentradas en un pequeño núcleo central, mientras que los electrones giraban alrededor de este núcleo a distancias relativamente grandes.
El modelo de Rutherford revolucionó la comprensión de la estructura del átomo al proponer que el átomo era principalmente espacio vacío con un núcleo denso en el centro, donde se concentraba la mayor parte de la masa y carga positiva. Además, su modelo planteaba la existencia de electrones girando alrededor del núcleo en órbitas definidas. Este modelo sentó las bases para futuros desarrollos y teorías sobre la estructura y comportamiento de los átomos, y cambió para siempre nuestra visión de la materia y la física fundamental.
Cuáles son las limitaciones del modelo de Rutherford
El modelo de Rutherford, propuesto por el físico Ernest Rutherford en 1911, fue una contribución importante para el entendimiento de la estructura del átomo. Sin embargo, a medida que se realizaron más investigaciones y se desarrollaron nuevas teorías, se descubrieron ciertas limitaciones en el modelo de Rutherford.
Falta de explicación para la estabilidad del átomo
Una de las principales limitaciones del modelo de Rutherford es que no explica cómo los electrones pueden mantenerse en órbita alrededor del núcleo sin caer hacia él debido a la fuerza de atracción electrostática. Según las leyes de la física clásica, los electrones deberían perder energía y eventualmente colapsar en el núcleo.
Para solucionar este problema, se propusieron algunas modificaciones al modelo de Rutherford, como las órbitas cuantizadas propuestas por Niels Bohr. Estas órbitas específicas permiten que los electrones se mantengan en un estado estable y no caigan hacia el núcleo.
La ausencia de niveles de energía definidos
Otra limitación del modelo de Rutherford es que no proporciona una explicación adecuada para los niveles de energía discretos observados en el espectro de emisión de algunos elementos. Los experimentos mostraron que los electrones emitían y absorbían energía solo en ciertos valores específicos, conocidos como niveles de energía.
Este fenómeno se explica mejor mediante el modelo de mecánica cuántica, que introduce el concepto de orbitales y niveles de energía bien definidos. En el modelo de Rutherford, las órbitas son continuas y no hay una explicación para la existencia de estos niveles discretos.
La falta de explicación para las propiedades magnéticas de los átomos
El modelo de Rutherford también tiene dificultades para explicar las propiedades magnéticas observadas en algunos átomos. Resulta que los electrones tienen un momento magnético intrínseco, conocido como espín, que contribuye a las propiedades magnéticas del átomo.
En el modelo de Rutherford, los electrones simplemente se mueven alrededor del núcleo sin tener en cuenta sus momentos magnéticos. Para una explicación más completa de las propiedades magnéticas de los átomos, es necesario recurrir al modelo de mecánica cuántica y considerar el espín de los electrones en su descripción.
Aunque el modelo de Rutherford fue un avance significativo en la comprensión de la estructura del átomo, presentaba varias limitaciones que posteriormente fueron superadas por desarrollos teóricos posteriores. La incorporación de ideas de la mecánica cuántica proporcionó una explicación más completa y precisa de fenómenos observados, como la estabilidad del átomo, los niveles de energía y las propiedades magnéticas.
Cómo ha evolucionado el modelo atómico desde los tiempos de Rutherford
El modelo atómico propuesto por Ernest Rutherford en 1911 fue un gran avance en nuestra comprensión de la estructura del átomo. Antes de su descubrimiento, se creía que el átomo era una "sopa" uniforme de carga positiva con los electrones incrustados en ella de manera dispersa.
Sin embargo, los experimentos de Rutherford con partículas alfa demostraron que esta visión no era correcta. En su famoso experimento de dispersión de partículas alfa, Rutherford bombardeó finas láminas de oro con estas partículas cargadas positivamente y observó los patrones resultantes.
Para su sorpresa, algunas partículas alfa pasaron a través de la lámina sin ser desviadas, mientras que otras experimentaron una desviación significativa. Incluso hubo casos en los que las partículas alfa rebotaron hacia atrás en la dirección opuesta a la original.
Estos resultados llevaron a Rutherford a proponer un modelo completamente nuevo para explicar el comportamiento de las partículas en su experimento. Según su interpretación, el átomo estaba compuesto principalmente por espacio vacío, donde se encontraba un núcleo pequeño y denso cargado positivamente. Los electrones, en cambio, giraban alrededor del núcleo en órbitas definidas.
Esta idea revolucionaria desafió las creencias aceptadas hasta ese momento y sentó las bases para el desarrollo posterior de teorías más completas sobre la estructura del átomo.
Características principales del modelo de Rutherford
A continuación, se presentan las características clave del modelo de Rutherford:
- El átomo está compuesto principalmente por espacio vacío.
- El núcleo es pequeño y contiene casi toda la masa del átomo.
- El núcleo está cargado positivamente.
- Los electrones giran alrededor del núcleo en órbitas definidas.
Estas características permitieron a los científicos ampliar su comprensión de la estructura atómica y desarrollar nuevos modelos que pudieran explicar fenómenos aún más complejos.
¿Qué impacto ha tenido el modelo de Rutherford en la comprensión actual de la física?
Estos son solo algunos de los temas que se pueden abordar al explorar la fascinante explicación del modelo de Rutherford y su influencia en nuestra comprensión de la estructura del átomo. Hay muchas más preguntas y aspectos interesantes que descubrir en este tema tan importante para la ciencia.
El modelo de Rutherford, también conocido como modelo planetario del átomo, fue propuesto por el físico neozelandés Ernest Rutherford en 1911. Este modelo revolucionó nuestra comprensión de la estructura atómica y sentó las bases para desarrollos posteriores en la teoría cuántica.
Antes del modelo de Rutherford, se creía que el átomo era una estructura sólida e indivisible. Sin embargo, los experimentos realizados por Rutherford y su equipo demostraron lo contrario. Mediante la famosa "experiencia de la lámina de oro", Rutherford bombardeó una lámina muy delgada de oro con partículas alfa, que son partículas cargadas positivamente presentes en la radiación decaimiento del uranio.
La sorprendente observación de este experimento fue que la mayoría de las partículas alfa pasaban rectas a través de la lámina de oro, mientras que algunas eran desviadas en ángulos muy agudos. Esta observación desafiaba la idea de un átomo sólido y llevó a Rutherford a la conclusión de que el átomo era principalmente espacio vacío, con un núcleo denso y cargado positivamente en su centro.
Explicación del modelo de Rutherford
Según el modelo de Rutherford, el átomo está compuesto por un núcleo pequeño y denso en su centro, donde residen los protones cargados positivamente y los neutrones sin carga. Alrededor del núcleo, los electrones cargados negativamente giran en órbitas circulares.
Esta analogía del modelo planetario del átomo es una simplificación, ya que los electrones no se mueven en órbitas precisas como los planetas alrededor del sol. En cambio, los electrones se comportan más como partículas ondulatorias y ocupan regiones de espacio llamadas orbitales o capas electrónicas.
La carga positiva del núcleo mantiene a los electrones unidos al átomo, ya que las fuerzas electrostáticas atraen a los electrones cargados negativamente hacia el núcleo cargado positivamente. La estabilidad del átomo depende del equilibrio entre estas fuerzas de atracción y la energía requerida para que los electrones se alejen del núcleo.
A pesar de sus limitaciones y simplificaciones, el modelo de Rutherford sentó las bases para el desarrollo posterior de la teoría cuántica y nos proporcionó una nueva comprensión de la estructura del átomo. Fue un avance significativo en nuestra comprensión de la física y abrió la puerta a futuras investigaciones y descubrimientos en este campo.
Preguntas frecuentes (FAQ)
1. ¿Quién fue Ernest Rutherford?
Ernest Rutherford fue un famoso físico y químico neozelandés considerado uno de los padres de la física nuclear.
2. ¿En qué consiste el modelo de Rutherford para la estructura del átomo?
El modelo de Rutherford propone que el átomo tiene un núcleo central cargado positivamente, donde se encuentra la mayor parte de la masa, y que los electrones giran alrededor del núcleo en órbitas definidas.
3. ¿Cuál es la principal contribución del modelo de Rutherford?
La principal contribución del modelo de Rutherford fue demostrar que el núcleo del átomo es pequeño y denso, además de contener protones con carga positiva.
4. ¿Cómo se llevó a cabo el experimento de Rutherford?
El experimento de Rutherford consistió en bombardear partículas alfa sobre una lámina de oro muy delgada y observar cómo se dispersaban. Esto permitió deducir la existencia del núcleo atómico.
5. ¿Por qué el modelo de Rutherford no está totalmente correcto?
El modelo de Rutherford no está totalmente correcto porque no explica la estabilidad del átomo ni la distribución precisa de los electrones alrededor del núcleo.
Deja una respuesta
Entradas relacionadas