Cantidad de electrones en cada capa: Descubre el increíble mundo de los electrones y cómo se organizan en las capas atómicas
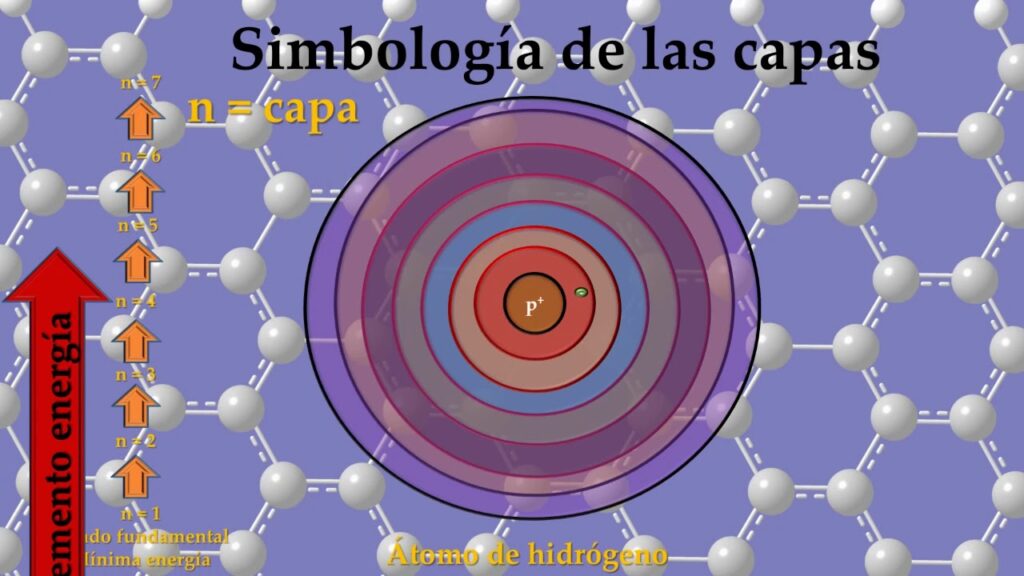
La estructura electrónica de los átomos es un tema fascinante en la química y la física. Los electrones son partículas subatómicas cargadas negativamente que orbitan alrededor del núcleo atómico, y se organizan en capas o niveles energéticos. Estas capas están numeradas del 1 al 7, empezando por la capa más interna y cercana al núcleo.
En este artículo exploraremos cómo se distribuyen los electrones en estas capas, siguiendo el principio de Aufbau y la regla del octeto. Además, veremos las diferentes categorías de elementos en la tabla periódica según el número de electrones en su capa más externa. ¡Sigue leyendo para descubrir más sobre el increíble mundo de los electrones y su organización en las capas atómicas!
- Qué son los electrones y cuál es su importancia en el átomo
- Cómo se organizan los electrones en capas dentro del átomo
- Cuántos electrones puede tener cada capa atómica
- Cuáles son las capas atómicas más importantes y qué características tienen
- Reglas de distribución electrónica
- Cómo determinar la cantidad de electrones en cada capa
- Qué ocurre cuando un átomo tiene más o menos electrones de lo normal en una capa específica
- Cuáles son las implicaciones de tener una configuración electrónica inestable
- Qué otras propiedades y comportamientos de los electrones podemos entender a través de su distribución en capas
Qué son los electrones y cuál es su importancia en el átomo
Los electrones son partículas subatómicas que tienen una carga negativa y giran alrededor del núcleo del átomo. Son parte fundamental de la estructura de los átomos y desempeñan un papel crucial en las propiedades y comportamientos de los elementos químicos.
La importancia de los electrones radica en el hecho de que su número y distribución determinan las propiedades químicas de un elemento. La forma en que se organizan en las capas atómicas permite a los átomos formar enlaces químicos, participar en reacciones químicas y determinar su reactividad. Además, los electrones también están involucrados en procesos como la conducción eléctrica y la emisión y absorción de radiación electromagnética.
Cómo se organizan los electrones en capas dentro del átomo
Los electrones son partículas subatómicas con carga negativa que orbitan alrededor del núcleo de un átomo. La forma en que se organizan en capas alrededor del núcleo atómico es fundamental para entender la estructura de los átomos y cómo interactúan entre sí para formar moléculas y compuestos.
En el modelo tradicional del átomo, conocido como el modelo de Schrödinger, las capas electrónicas están definidas por valores de energía. A medida que nos alejamos del núcleo, cada capa tiene una energía superior a la anterior. Estas energías se representan mediante números cuánticos, donde la capa más cercana al núcleo tiene un número cuántico principal (n) igual a 1, la siguiente capa tiene un n igual a 2, y así sucesivamente.
Cada capa puede contener diferentes cantidades de electrones. En la capa n=1, también conocida como capa K, solo puede haber un máximo de 2 electrones. Esto se debe a que solo hay un subnivel s disponible, denominado subnivel s. El subnivel s puede albergar un máximo de 2 electrones, uno con un espín hacia arriba y otro con un espín hacia abajo.
En la capa n=2, o capa L, hay un subnivel s y tres subniveles p. Cada subnivel p puede alojar un máximo de 2 electrones, lo que significa que la capa L puede albergar hasta un total de 8 electrones (2 del subnivel s y 6 de los subniveles p).
La capa n=3, o capa M, tiene un subnivel s, tres subniveles p y cinco subniveles d. Nuevamente, cada subnivel puede contener 2 electrones, por lo que la capa M puede albergar hasta 18 electrones (2 del subnivel s, 6 de los subniveles p y 10 de los subniveles d).
Este patrón continúa a medida que avanzamos a capas más externas, donde las capas n=4, n=5, n=6, etc., pueden albergar un número aún mayor de electrones debido a la presencia de más subniveles disponibles. Sin embargo, es importante tener en cuenta que existe una regla llamada el principio de exclusión de Pauli, que establece que ningún electrón puede compartir los mismos cuatro números cuánticos (número cuántico principal, número cuántico secundario, número cuántico magnético y número cuántico de espín), lo que significa que cada capa y subnivel debe llenarse antes de proceder al siguiente.
Los electrones se organizan en capas alrededor del núcleo atómico, con cada capa definida por su número cuántico principal. A medida que nos alejamos del núcleo, cada capa puede contener más electrones debido a la inclusión de subniveles adicionales. Conocer la cantidad de electrones en cada capa es fundamental para comprender la configuración electrónica de los átomos y cómo interactúan en reacciones químicas y enlaces químicos.
Cuántos electrones puede tener cada capa atómica
Los electrones son partículas subatómicas que giran alrededor del núcleo de un átomo. Estos electrones se organizan en capas atómicas, también conocidas como niveles de energía. Cada capa puede contener un número limitado de electrones, y este límite está determinado por la estructura electrónica del átomo.
La cantidad de electrones que puede contener cada capa atómica sigue una secuencia específica. La primera capa, llamada capa K, puede contener hasta 2 electrones. La segunda capa, llamada capa L, puede contener hasta 8 electrones. La tercera capa, capa M, puede contener hasta 18 electrones. Y así sucesivamente.
Es importante tener en cuenta que estas capacidades máximas se basan en reglas y principios establecidos por la mecánica cuántica, una teoría que describe el comportamiento de las partículas subatómicas. Estos principios incluyen el principio de exclusión de Pauli y el principio de aufbau, entre otros.
El principio de exclusión de Pauli establece que no puede haber más de dos electrones en un mismo estado cuántico, lo que implica que en una capa pueden existir como máximo 2 electrones en cada uno de los subniveles s, p, d y f. Esto explica por qué la capa K solo puede contener hasta 2 electrones.
Por otro lado, el principio de aufbau establece que los electrones llenan las capas en orden ascendente de energía, es decir, se van llenando primero las capas más cercanas al núcleo y luego las más alejadas. Esto explica por qué la capa L, que es la segunda capa más cercana al núcleo, puede contener hasta 8 electrones.
Esta secuencia se repite para cada una de las capas atómicas, donde cada capa puede contener más electrones que la anterior debido a su mayor distancia promedio del núcleo y, por lo tanto, a su mayor energía.
Es importante destacar que si un átomo tiene menos electrones que los máximos permitidos en cada capa, estos se distribuyen de manera desigual entre los diferentes subniveles de la capa. Por ejemplo, el nitrógeno (N) tiene un total de 7 electrones, por lo que en su capa K solo tiene 2 electrones en el subnivel s y en su capa L tiene 5 electrones, 2 en el subnivel s y 3 en el subnivel p.
La cantidad de electrones que puede tener cada capa atómica sigue una secuencia específica basada en principios y reglas establecidas por la mecánica cuántica. Estos límites son importantes para comprender cómo se organiza y distribuye la carga negativa de los electrones alrededor del núcleo en un átomo.
Cuáles son las capas atómicas más importantes y qué características tienen
Las capas atómicas son regiones alrededor del núcleo de un átomo donde los electrones se organizan y orbitan. Estas capas están designadas con letras; las más cercanas al núcleo son K, L, M, N, O, P, y Q. Cada capa tiene un límite específico de electrones que puede contener.
Capa K
La capa K es la más cercana al núcleo y puede contener un máximo de 2 electrones.
Capa L
La capa L está después de la capa K y puede contener un máximo de 8 electrones.
Capa M
La capa M sigue a la capa L y puede contener un máximo de 18 electrones.
Capa N
La capa N es la siguiente después de la capa M y puede contener un máximo de 32 electrones.
Capa O
La capa O sigue la capa N y puede contener un máximo de 32 electrones.
Capa P
La capa P viene después de la capa O y puede contener un máximo de 18 electrones.
Capa Q
La capa Q es la más alejada del núcleo y puede contener un máximo de 8 electrones.
Es importante destacar que el orden mencionado aquí no es siempre estricto, ya que algunos elementos químicos pueden tener un número diferente de electrones en cada capa. Sin embargo, esta es la estructura general utilizada para describir cómo los electrones se ubican en las diferentes capas.
Reglas de distribución electrónica
La distribución electrónica se refiere a cómo los electrones se asignan o distribuyen en las diferentes capas atómicas de un átomo. Esta distribución sigue algunas reglas básicas:
- Principio de Aufbau: los electrones llenan las capas más cercanas al núcleo antes de pasar a las siguientes capas más alejadas.
- Principio de Hund: cuando hay subcapas en una misma capa, los electrones deben distribuirse en diferentes orbitales antes de ocupar el mismo orbital.
- Principio de la máxima multiplicidad de espín: los electrones tendrá el mismo espín (up o down) antes de aparearse con otro electrón en la misma órbita.
Estas reglas ayudan a explicar la configuración electrónica de los átomos y cómo los electrones se organizan en las capas atómicas.
Cómo determinar la cantidad de electrones en cada capa
La distribución de electrones en cada capa atómica sigue un patrón específico y predecible. Para determinar la cantidad de electrones en cada capa, es importante comprender cómo se organiza el modelo de capas atómicas.
El modelo de capas atómicas se basa en el principio de Aufbau, que establece que los electrones llenan las capas más cercanas al núcleo antes de moverse a capas más externas. Cada capa puede contener un número máximo de electrones, que varía según su distancia al núcleo.
Capa 1: Capa K
La capa más cercana al núcleo es la capa K. Esta capa solo puede contener un máximo de 2 electrones. Estos electrones ocupan los niveles energéticos 1s.
Capa 2: Capa L
La siguiente capa en orden de proximidad al núcleo es la capa L. La capa L tiene dos subcapas, llamadas subcapas s y p. La subcapa s puede contener hasta 2 electrones, mientras que la subcapa p puede contener hasta 6 electrones.
En total, la capa L puede contener un máximo de 8 electrones. Los electrones llenan primero la subcapa s (2 electrones) y luego la subcapa p (6 electrones).
Capa 3: Capa M
La tercera capa en orden de proximidad al núcleo es la capa M. Al igual que la capa L, la capa M también tiene subcapas s y p. La subcapa s puede contener hasta 2 electrones, mientras que la subcapa p puede contener hasta 6 electrones.
Además de las subcapas s y p, la capa M también tiene una subcapa d, que puede contener hasta 10 electrones. En total, la capa M puede contener un máximo de 18 electrones. Los electrones llenan primero la subcapa s (2 electrones), luego la subcapa p (6 electrones) y finalmente la subcapa d (10 electrones).
Capa 4: Capa N
La cuarta capa en orden de proximidad al núcleo es la capa N. Al igual que las capas anteriores, la capa N tiene subcapas s, p y d. La subcapa s puede contener hasta 2 electrones, la subcapa p hasta 6 electrones y la subcapa d hasta 10 electrones.
Además de las subcapas s, p y d, la capa N también tiene una subcapa f, que puede contener hasta 14 electrones. En total, la capa N puede contener un máximo de 32 electrones. Los electrones siguen el mismo orden de llenado que en las capas anteriores: subcapa s (2 electrones), subcapa p (6 electrones), subcapa d (10 electrones) y luego subcapa f (14 electrones).
El patrón continúa a medida que se agregan más capas atómicas, con subcapas adicionales que pueden contener más electrones. Cada capa nueva se comporta de manera similar a las anteriores, llenando primero las subcapas más cercanas al núcleo antes de pasar a las subcapas externas.
Es importante tener en cuenta que el modelo de capas atómicas es una simplificación y que la distribución real de electrones puede variar debido a diferentes factores, como la carga nuclear efectiva y las interacciones electrostáticas entre los electrones.
Qué ocurre cuando un átomo tiene más o menos electrones de lo normal en una capa específica
En un átomo, los electrones están organizados en capas atómicas o niveles de energía. Cada capa tiene una capacidad máxima de electrones que puede albergar, y esta capacidad aumenta a medida que nos movemos hacia capas más externas.
La cantidad de electrones en cada capa sigue un patrón específico. La primera capa, también conocida como capa K, puede contener hasta 2 electrones. La segunda capa, capa L, puede albergar hasta 8 electrones. La tercera capa, capa M, tiene una capacidad máxima de 18 electrones. Y así sucesivamente, con cada capa superior teniendo una capacidad mayor que la anterior.
Pero, ¿qué ocurre cuando un átomo tiene más o menos electrones de lo normal en una capa específica?
Cuando un átomo tiene menos electrones de lo normal en una capa:
- Si un átomo tiene menos electrones en una capa de lo que debería tener según su posición en la tabla periódica, esa capa se considera incompleta o "inestable".
- Los átomos con capas inestables tienden a ser muy reactivos, ya que buscan adquirir o ceder electrones para alcanzar la estabilidad.
- Esto explica por qué algunos elementos químicos son altamente reactivos y propensos a formar compuestos químicos con otros átomos.
- Un ejemplo común es el caso del cloro (Cl), que necesita ganar un electrón para completar su capa externa y alcanzar la configuración del gas noble argón (Ar).
Cuando un átomo tiene más electrones de lo normal en una capa:
- Si un átomo tiene más electrones en una capa de lo que debería tener según su posición en la tabla periódica, esa capa se considera sobrepoblada o "inestable".
- Los átomos con capas sobrepobladas también tienden a ser reactivos, ya que buscan desprenderse de los electrones adicionales para alcanzar la estabilidad.
- Esto se observa en ciertos metales de transición, como el cromo (Cr) y el cobre (Cu), que tienen capacidad para 6 electrones en la capa M, pero pueden albergar hasta 9 electrones debido a su configuración electrónica. Estos metales exhiben propiedades particulares debido a esta sobrepoblación en su capa exterior.
La cantidad de electrones en cada capa atómica determina la estabilidad y las propiedades químicas de un átomo. Cuando un átomo tiene menos o más electrones de lo normal en una capa específica, busca ganar o perder electrones para alcanzar la estabilidad y satisfacer su configuración electrónica.
Cuáles son las implicaciones de tener una configuración electrónica inestable
Una configuración electrónica inestable puede tener diversas implicaciones en el comportamiento y las propiedades de un átomo. Cuando un átomo tiene una cantidad excesiva o insuficiente de electrones en sus capas exteriores, su estabilidad se ve comprometida.
En primer lugar, una configuración electrónica inestable puede hacer que un átomo sea altamente reactivo. Los átomos con capas exteriores incompletas tienden a buscar electrones adicionales para completar su configuración. Por lo tanto, estos átomos tienden a formar enlaces químicos con otros átomos para adquirir los electrones que les faltan. Esto puede resultar en la formación de moléculas y compuestos con una variedad de propiedades químicas y físicas.
Por otro lado, algunos átomos pueden tener una configuración electrónica inestable debido a un exceso de electrones en sus capas exteriores. Estos átomos pueden liberar fácilmente los electrones adicionales y convertirse en iones positivos. Los iones positivos son altamente reactivos y tienden a buscar átomos u otras moléculas para obtener electrones adicionales y equilibrar su carga positiva. Esto puede dar lugar a reacciones químicas y a la formación de compuestos con propiedades diferentes a las de los átomos originales.
Además, una configuración electrónica inestable también puede afectar las propiedades físicas de un átomo. Por ejemplo, los átomos con una configuración electrónica inestable pueden tener una mayor tendencia a ganar o perder electrones durante una reacción química, lo que puede influir en sus puntos de fusión y ebullición. También pueden ser más propensos a formar compuestos con propiedades magnéticas o conductivas, dependiendo de la naturaleza de los electrones implicados.
Una configuración electrónica inestable tiene implicaciones significativas en el comportamiento químico y las propiedades físicas de un átomo. Estas implicaciones pueden variar ampliamente dependiendo de la cantidad de electrones involucrados y del tipo de elementos y compuestos con los que interactúa.
Qué otras propiedades y comportamientos de los electrones podemos entender a través de su distribución en capas
La distribución de los electrones en las diferentes capas atómicas es un factor fundamental para comprender algunas propiedades y comportamientos de estos elementos subatómicos. A través de esta organización, podemos entender cómo se llevan a cabo los enlaces químicos, la estabilidad de los átomos y la formación de iones.
Una de las propiedades más importantes que podemos analizar es la capacidad de los átomos para establecer enlaces químicos. En este sentido, la distribución de los electrones en las capas nos permite determinar si un átomo tiene una configuración electrónica estable o si necesita ganar, perder o compartir electrones con otros átomos para alcanzar dicha estabilidad.
Por ejemplo, aquellos átomos que tienen su última capa totalmente llena, como los gases nobles, son muy estables y poco propensos a reaccionar químicamente. Esto se debe a que ya tienen el número máximo de electrones permitido en su capa externa, por lo que no necesitan interactuar con otros átomos para alcanzar la estabilidad.
Por otro lado, los átomos que tienen su última capa incompleta tienden a ser más reactivos, ya que buscan adquirir o perder electrones para completar su capa externa y, de esta manera, alcanzar la estabilidad. Por ejemplo, los elementos del grupo 1 (como el sodio) tienen un electrón en su última capa, por lo que tienen mayor tendencia a perderlo y formar cationes con carga positiva.
Otra propiedad relacionada con la distribución de los electrones en las capas es el radio atómico. En general, el radio atómico aumenta a medida que nos desplazamos hacia abajo en un grupo de la tabla periódica. Esto se debe a que, al agregar capas adicionales de electrones, el tamaño del átomo se incrementa. Por el contrario, al desplazarnos de izquierda a derecha en un periodo, el radio atómico disminuye debido a la mayor atracción ejercida por el núcleo sobre los electrones.
Asimismo, la distribución de los electrones en las capas también influye en las propiedades magnéticas de los materiales. Los elementos con un número impar de electrones en su última capa tienden a ser paramagnéticos, lo que significa que tienen una leve atracción hacia los campos magnéticos externos. Por otro lado, los elementos con un número par de electrones en su última capa tienden a ser diamagnéticos, es decir, son levemente repelidos por los campos magnéticos externos.
La distribución de los electrones en las diferentes capas atómicas proporciona información crucial para comprender diversas propiedades y comportamientos de los átomos. Esta organización nos permite entender cómo se llevan a cabo los enlaces químicos, la estabilidad de los átomos y la formación de iones, así como las propiedades magnéticas y el tamaño de los átomos. Es un fascinante mundo subatómico que sigue sorprendiéndonos con sus numerosas aplicaciones y descubrimientos.
En la primera capa atómica, también conocida como capa K, puede haber un máximo de 2 electrones.
En la segunda capa atómica, también conocida como capa L, pueden haber hasta un máximo de 8 electrones.
La tercera capa atómica, también conocida como capa M, puede albergar hasta un máximo de 18 electrones.
En la cuarta capa atómica, también conocida como capa N, pueden haber un máximo de 32 electrones.
La quinta capa atómica, también conocida como capa O, puede contener hasta un máximo de 50 electrones.
Deja una respuesta
Entradas relacionadas