Descubre la regla de Hund: el secreto detrás del orden de llenado de orbitales
El orden de llenado de orbitales es un concepto clave en la química que nos ayuda a entender cómo se distribuyen los electrones en los átomos y moléculas. Siguiendo este orden, podemos determinar tanto la configuración electrónica de un átomo como su comportamiento químico. Una regla que explica este orden de llenado es la regla de Hund, la cual nos dice cómo se llenan los orbitales degenerados antes de empezar a parear los electrones.
Exploraremos en detalle la regla de Hund y cómo se aplica en el llenado de orbitales. Veremos cómo esta regla contribuye a una mayor estabilidad y menor energía del sistema, y cómo esto se relaciona con las propiedades químicas y físicas de los elementos. También discutiremos algunos ejemplos prácticos de aplicación de la regla de Hund en el estudio de la estructura electrónica de los átomos y las moléculas. ¡Acompáñanos en esta fascinante excursión al mundo de los electrones y sus orbitales!
- Qué es la regla de Hund y cuál es su importancia en la química
- Cuál es el orden de llenado de orbitales según la regla de Hund
- Por qué se utilizan las flechas para representar los electrones en los orbitales
- Cuáles son los diferentes tipos de subniveles y cómo se relacionan con la regla de Hund
- Cómo se aplica la regla de Hund en la construcción de la tabla periódica
- Cuáles son algunas excepciones a la regla de Hund
- Cuál es la relación entre la regla de Hund y las propiedades químicas de los elementos
- Cómo afecta la regla de Hund a la configuración electrónica de un átomo
- Cuál es la relevancia de la regla de Hund en la determinación de la reactividad de los elementos
- ¿Cómo se puede aplicar la regla de Hund en ejercicios de química y cálculos de configuración electrónica?
- Estos son algunos de los temas que podría abordar en mi artículo sobre la regla de Hund.
Qué es la regla de Hund y cuál es su importancia en la química
La regla de Hund es un principio en la mecánica cuántica que describe cómo se llenan los orbitales en átomos y moléculas. Es una regla fundamental en la química y tiene una gran importancia en la comprensión de las propiedades y comportamientos de los elementos.
De acuerdo con la regla de Hund, cuando se llenan los orbitales de una subcapa degenerada, es decir, aquellos que tienen la misma energía, los electrones ocuparán primero los orbitales de manera individual y con su espín paralelo antes de comenzar a emparejarse. Esto significa que un electrón ocupará cada orbital vacío disponible antes de que dos electrones ocupen el mismo orbital con sus espines opuestos.
Esta regla se basa en el principio de exclusión de Pauli, que establece que ningún electrón puede tener los mismos números cuánticos y, por lo tanto, les impide ocupar el mismo espacio de forma simultánea. Al seguir la regla de Hund, los electrones maximizan su desorden y minimizan la repulsión entre ellos, lo que resulta en una distribución de electrones más estable en los orbitales y una disminución en la energía del sistema.
La regla de Hund es una parte clave del modelo de capas electrónicas, que organiza los electrones en diferentes niveles y subniveles energéticos alrededor del núcleo de un átomo. Esta organización influye en muchas propiedades y comportamientos químicos, como la reactividad, la estabilidad y las configuraciones electrónicas de los elementos.
Además de su significado teórico y su importancia en la comprensión de la estructura electrónica de los átomos, la regla de Hund también tiene aplicaciones prácticas. Por ejemplo, es utilizada en la determinación de las configuraciones electrónicas de los elementos y ayuda a predecir la forma en que los átomos se unen entre sí y forman moléculas.
La regla de Hund es una regla fundamental en la química que establece cómo se llenan los orbitales en átomos y moléculas. Su aplicación permite entender y predecir propiedades y comportamientos químicos, y además, facilita la determinación de las configuraciones electrónicas de los elementos.
Cuál es el orden de llenado de orbitales según la regla de Hund
La regla de Hund es una regla en la química cuántica que describe el orden de llenado de los orbitales en un átomo. Esta regla se basa en el principio de máxima multiplicidad, lo cual significa que los electrones tienden a ocupar los orbitales de manera que haya el máximo de electrones con espines paralelos.
En otras palabras, los electrones prefieren ocupar diferentes orbitales antes de emparejarse en un mismo orbital. Esto se debe a que los electrones tienen carga negativa y se repelen entre sí debido a su igual carga. Al ocupar diferentes orbitales, pueden mantener una mayor separación y minimizar la repulsión electrostática.
El orden de llenado de orbitales según la regla de Hund sigue un patrón específico. Este patrón se basa en los números cuánticos de los orbitales, que son aquellos valores que describen las características de los electrones en un átomo.
- Primeramente, los orbitales se llenan en orden creciente de energía. Los orbitales en un átomo están organizados en niveles de energía, llamados capas. Dentro de cada capa, hay subcapas que corresponden a los orbitales s, p, d, f, etc. El orden de llenado comienza por la capa más cercana al núcleo y continúa hacia afuera.
- Una vez que se selecciona la capa correcta, se llena primero el orbital con el menor número cuántico magnético (m), que indica la orientación espacial del orbital en esa capa. Por ejemplo, si la capa tiene orbitales p, se llena primero el orbital con m=0 antes que los que tienen m=1 o m=-1.
- Después de llenar el primer orbital, se procede a llenar los siguientes orbitales en orden creciente de número cuántico magnético. En el caso de los orbitales p, esto significaría llenar los orbitales con m=1 y m=-1 después del orbital con m=0.
- Finalmente, cuando los orbitales de una subcapa están llenos hasta la mitad de su capacidad (dos electrones en cada uno), los electrones comienzan a emparejarse en los orbitales existentes antes de llenar nuevos orbitales.
La regla de Hund es fundamental para entender cómo se organizan los electrones en los átomos y cómo determinar la configuración electrónica de un elemento químico. Además, esta regla también tiene aplicaciones en la comprensión de la periodicidad y las propiedades de los elementos en la tabla periódica.
Por qué se utilizan las flechas para representar los electrones en los orbitales
Las flechas se utilizan para representar los electrones en los orbitales debido a que proporcionan una forma visual clara y concisa de mostrar la dirección del espín. El espín es una propiedad intrínseca de las partículas subatómicas, como los electrones, y puede tener dos valores posibles: hacia arriba (+1/2) o hacia abajo (-1/2).
Cuando se llenan los orbitales con electrones, deben seguirse ciertas reglas, como la regla de Hund, para garantizar el orden correcto de llenado. Esta regla establece que los electrones ocupan orbital individualmente antes de emparejarse.
Para representar esto, se utilizan flechas. Una flecha hacia arriba (↑) representa un electrón con espín hacia arriba, mientras que una flecha hacia abajo (↓) representa un electrón con espín hacia abajo.
Al dibujar las flechas en los orbitales, se sigue un patrón específico para asegurar que se respete la regla de Hund y se siga el orden de llenado de los orbitales. Este patrón se basa en la distribución electrónica de los elementos y nos permite entender mejor cómo se organizan los electrones en los átomos y moléculas.
Cuáles son los diferentes tipos de subniveles y cómo se relacionan con la regla de Hund
Antes de sumergirnos en la regla de Hund, es importante entender los diferentes tipos de subniveles y cómo se relacionan entre sí.
En el modelo de capas electrónicas, los átomos están formados por diferentes niveles de energía llamados "capas". Estas capas están compuestas por subniveles, que a su vez están compuestos por orbitales. Cada subnivel tiene un número máximo de orbitales que puede contener, y cada orbital puede albergar un máximo de dos electrones con espines opuestos según el principio de exclusión de Pauli.
Tipo de subniveles
- s: Este tipo de subnivel está compuesto por un solo orbital esférico, conocido como orbital s. Existe un subnivel s en cada nivel de energía y puede contener hasta dos electrones.
- p: Los subniveles p están compuestos por tres orbitales perpendiculares entre sí, que pueden denominarse como px, py, y pz. Por lo tanto, cada subnivel p puede alojar hasta seis electrones.
- d: Los subniveles d son más complejos y están compuestos por cinco orbitales con diversas formas. Estos orbitales, designados como dxy, dxz, dyz, dx²-y², y dz², tienen diferentes orientaciones espaciales y pueden alojar hasta diez electrones.
- f: Los subniveles f son aún más complejos y pueden contener hasta siete orbitales, cada uno con formas y orientaciones únicas. Estos orbitales se denominan como fxyz, fx(x²-3y²), fy(3x²-y²), fz(x²-y²), fxz², fyz², y fz³. En total, los subniveles f tienen una capacidad máxima de catorce electrones.
El orden en el que los subniveles se llenan sigue una secuencia determinada, conocida como regla de Hund.
Cómo se aplica la regla de Hund en la construcción de la tabla periódica
Para comprender cómo se aplica la regla de Hund en la construcción de la tabla periódica, primero debemos entender qué es la regla de Hund y cuál es su importancia en este proceso.
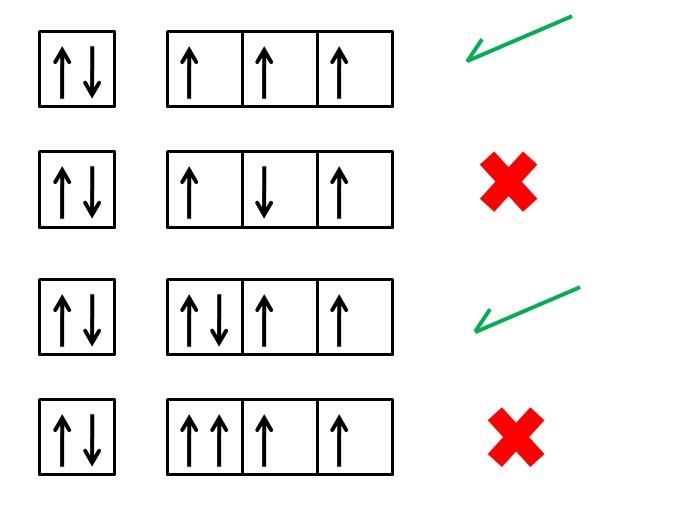
La regla de Hund establece que cuando se llenan los orbitales de una misma subcapa, se debe ocupar cada uno de ellos con un electrón antes de añadir el segundo electrón. Esto significa que los electrones deben distribuirse de manera que todos los orbitales tengan al menos un electrón antes de aparearse.
¿Por qué es importante seguir esta regla al construir la tabla periódica? La respuesta está en la configuración electrónica de los elementos químicos. La configuración electrónica nos indica cómo se distribuyen los electrones en los diferentes orbitales de un átomo. Al seguir la regla de Hund, se garantiza que la configuración electrónica sea lo más estable posible, minimizando las repulsiones entre los electrones.
Imaginemos el caso del carbono, que tiene una configuración electrónica de 1s2 2s2 2p2. Según la regla de Hund, al llenar los tres orbitales p (px, py, pz), se debe colocar un electrón en cada uno antes de aparearlos. Esto resulta en la configuración final 1s2 2s2 2p2 (↑↓) (↑↓) ↑ ↑.
Es importante tener en cuenta que la regla de Hund solo se aplica cuando se llenan los orbitales de una misma subcapa. En el caso del carbono, los electrones se distribuyen en la subcapa p, pero no aplicaría si estuviéramos llenando los orbitales de diferentes subcapas como 2s y 3d, por ejemplo.
La regla de Hund también explica por qué algunos elementos tienen configuraciones electrónicas inusuales. Un ejemplo es el cromo, que tiene la configuración 1s2 2s2 2p6 3s2 3p6 4s1 3d5. Siguiendo la regla de Hund, esperaríamos que los dos electrones no apareados se coloquen en dos orbitales diferentes, pero en lugar de eso, uno de los electrones se coloca en un orbital previamente semilleno (4s) y solo después los otros cuatro se agregan a la subcapa 3d.
La regla de Hund debe seguirse al llenar los orbitales de una misma subcapa en la construcción de la tabla periódica. Esta regla garantiza una configuración electrónica lo más estable posible, minimizando las repulsiones entre los electrones. Además, la regla de Hund explica algunas configuraciones electrónicas inusuales observadas en ciertos elementos químicos. ¡Sigue leyendo para descubrir más secretos detrás del orden de llenado de orbitales!
Cuáles son algunas excepciones a la regla de Hund
Si bien la regla de Hund es una guía general para determinar el orden de llenado de los orbitales en los átomos, existen algunas excepciones a esta regla que vale la pena mencionar. Estas excepciones ocurren cuando hay orbitales energéticamente más bajos disponibles para el llenado.
1. Excepción del cromo (Cr) y el molibdeno (Mo)
- En lugar de seguir la regla de llenado de un electrón por orbital, tanto el cromo como el molibdeno llenan un electrón en cada uno de sus orbitales antes de agregar el segundo electrón.
- En otras palabras, el diagrama electrónico del cromo será . 4s1 3d5, mientras que el del molibdeno será . 5s1 4d5.
Esta excepción se explica por la configuración electrónica más estable que se logra al tener todos los electrones desapareados en los orbitales d, en lugar de tener un par de electrones apareados.
2. Excepción del cobre (Cu) y la plata (Ag)
- Al igual que en el caso del cromo y el molibdeno, tanto el cobre como la plata siguen la misma pauta y llenan un electrón en cada uno de sus orbitales antes de agregar el segundo electrón.
- Por lo tanto, la configuración electrónica del cobre será . 4s1 3d10, mientras que la de la plata será . 5s1 4d10.
Esta excepción también se explica por la mayor estabilidad que se logra al tener todos los electrones desapareados en los orbitales d, en lugar de tener un par de electrones apareados.
3. Excepción del niobio (Nb) y el tecnecio (Tc)
- El niobio y el tecnecio siguen la regla general de llenado de orbitales, pero tienen una configuración electrónica anómala en su estado fundamental.
- La configuración electrónica del niobio es . 5s1 4d4, mientras que la del tecnecio es . 5s2 4d5.
Estas excepciones ocurren debido a la mayor estabilidad que se alcanza teniendo un medio orbital d completamente lleno en lugar de tener solo un electrón en ese medio orbital.
A pesar de estas excepciones, es importante tener en cuenta que la regla de Hund sigue siendo aplicable en la mayoría de los casos para predecir el orden de llenado de los orbitales en los átomos. Estas excepciones son solo algunos ejemplos peculiares que requieren un poco más de explicación y comprensión de la estructura electrónica de los elementos específicos.
Cuál es la relación entre la regla de Hund y las propiedades químicas de los elementos
La regla de Hund es un principio fundamental en la química cuántica que explica el orden de llenado de los orbitales en un átomo. Esta regla establece que, cuando se llenan subniveles con igual energía (como por ejemplo los orbitales p, d o f), los electrones tienden a ocupar diferentes orbitales antes de emparejarse. En otras palabras, los electrones prefieren ocupar orbitales vacíos de forma individual antes de compartir un orbital con otro electrón.
Esta regla tiene importantes implicancias en las propiedades químicas de los elementos. Debido a que los electrones ocupan diferentes orbitales de un subnivel antes de emparejarse, esto lleva a una mayor estabilidad del átomo. Al tener electrones en diferentes orbitales, se logra una repulsión mínima entre ellos, lo que reduce la energía total del sistema.
Esta configuración electrónica más estable afecta directamente las interacciones químicas y las propiedades de los elementos. Los electrones desapareados en orbitales diferentes pueden contribuir a una mayor reactividad, ya que están disponibles para participar en enlaces químicos con otros átomos. Esto es especialmente relevante en la formación de compuestos covalentes, donde los electrones son compartidos entre átomos.
Además, la regla de Hund tiene influencia en las propiedades magnéticas de los elementos. Dado que los electrones desapareados en orbitales diferentes tienen giros paralelos, generan un momento magnético neto y el elemento exhibe paramagnetismo. Este fenómeno permite detectar la presencia de ciertos elementos mediante técnicas espectroscópicas.
Cómo afecta la regla de Hund a la configuración electrónica de un átomo
La regla de Hund es una regla fundamental en la química cuántica que describe cómo se llenan los orbitales atómicos con electrones. Esta regla establece que, al llenar los orbitales de un subnivel, los electrones prefieren ocupar orbitales vacíos antes de emparejarse con otros electrones en el mismo orbital.
Para comprender mejor cómo afecta la regla de Hund a la configuración electrónica de un átomo, vamos a considerar el ejemplo del carbono (C) con número atómico 6. La configuración electrónica básica del carbono es 1s2 2s2 2p2, lo que significa que tiene dos electrones en el orbital 1s, dos en el orbital 2s y dos en el orbital 2p.
Configuración electrónica básica del átomo de carbono:
1s2: 2 electrones2s2: 2 electrones2p2: 2 electrones
Siguiendo la regla de Hund, cuando los orbitales están disponibles, los electrones tienden a ocupar diferentes orbitales antes de emparejarse entre sí. En el caso del carbono, los electrones del orbital 2p se distribuyen en orbitales separados antes de emparejarse. Por lo tanto, la configuración electrónica completa del carbono se representa como 1s2 2s2 2p2, con los electrones del orbital 2p distribuidos en orbitales separados.
Configuración electrónica del átomo de carbono siguiendo la regla de Hund:
1s2: 2 electrones2s2: 2 electrones2p1: 1 electrón2p1: 1 electrón
La importancia de la regla de Hund radica en que afecta las propiedades químicas y físicas de los elementos. Al ocupar diferentes orbitales antes de emparejarse, los electrones crean estructuras moleculares más estables y duraderas. Además, esta regla ayuda a explicar por qué algunos elementos tienen propiedades magnéticas, ya que los electrones no apareados generan un campo magnético.
La regla de Hund es una pauta clave para entender cómo se llenan los orbitales atómicos con electrones. Siguiendo esta regla, los electrones tienden a ocupar diferentes orbitales antes de emparejarse, lo que resulta en una configuración electrónica más estable y duradera para los átomos.
Cuál es la relevancia de la regla de Hund en la determinación de la reactividad de los elementos
La regla de Hund es una regla fundamental en la química que explica el orden de llenado de los orbitales en un átomo. Esta regla establece que cuando se ocupan los orbitales de igual energía, como los orbitales p y d, primero se distribuyen los electrones con sus espines desapareados, antes de emparejarlos.
Esta regla es de gran relevancia en la determinación de la reactividad de los elementos, ya que el orden de llenado de los orbitales influye directamente en las propiedades químicas de los elementos. Al analizar la configuración electrónica de un átomo, podemos entender su estructura electrónica y cómo interactúan los electrones en sus orbitales.
Cuando los electrones están distribuidos en orbitales de igual energía según la regla de Hund, el átomo tiende a ser más estable y presenta una menor repulsión electrostática entre los electrones. Esto facilita el intercambio y la compartición de electrones en reacciones químicas, lo que a su vez influye en la reactividad del elemento.
Por ejemplo, en el caso del carbono, cuya configuración electrónica es 1s2 2s2 2p2, los electrones se distribuyen en los tres orbitales 2p siguiendo la regla de Hund, con dos electrones desapareados en dos orbitales diferentes antes de emparejarse en el tercer orbital. Esta estructura electrónica hace que el carbono tenga una afinidad por compartir electrones y formar enlaces covalentes, lo que lo vuelve un elemento clave en la química orgánica y en la formación de compuestos biológicamente importantes.
En contraste, si los electrones se distribuyeran emparejados desde el principio siguiendo el principio de exclusión de Pauli (cada orbital puede contener un máximo de dos electrones con espines opuestos), habría una mayor repulsión electrostática entre los electrones y el átomo sería menos estable y menos reactividad.
La regla de Hund es fundamental para comprender y predecir las propiedades químicas de los elementos. El orden de llenado de los orbitales influye en la estructura electrónica de los átomos y en su reactividad, siendo determinante en la formación de enlaces químicos y en las reacciones químicas en general.
¿Cómo se puede aplicar la regla de Hund en ejercicios de química y cálculos de configuración electrónica?
La regla de Hund es fundamental para entender el orden en que los electrones se llenan en los orbitales. Específicamente, establece que cuando múltiples orbitales con la misma energía están disponibles, cada uno se llenará con un electrón antes de que cualquier orbital se llene con dos electrones.
Esta regla se basa en el principio de exclusión de Pauli, que establece que dos electrones en un átomo no pueden tener los mismos números cuánticos. Al seguir la regla de Hund, cumplimos con este principio ya que al llenar los orbitales con un solo electrón, aseguramos que los números cuánticos de estos sean diferentes.
Ejemplo de aplicación de la regla de Hund
Para ilustrar cómo se aplica esta regla, consideremos el caso del magnesio (Mg) que tiene una configuración electrónica abreviada de . 3s2. Esto significa que el Mg tiene 12 electrones y su diagrama orbital debe ser pensado en términos de niveles energéticos y subniveles.
El primer nivel energético es el nivel 1 y contiene el subnivel s. El segundo nivel energético se divide en subniveles s y p. En el caso del Mg, tenemos 2 electrones en el subnivel 1s y 10 electrones en el subnivel 2s y p.
Entonces, utilizando la regla de Hund, sabemos que el primer electrón en el subnivel 2s se coloca en un orbital. Luego, el segundo electrón también se colocará en otro orbital antes de completar el primero.
Después de llenar el subnivel 2s, pasamos al subnivel 2p. Nuevamente, siguiendo la regla de Hund, colocamos un electrón en cada uno de los tres orbitales p antes de comenzar a completarlos con un segundo electrón.
Cálculos de configuración electrónica utilizando la regla de Hund
Ahora que hemos comprendido cómo aplicar la regla de Hund en términos de ejemplos, podemos utilizarla para calcular configuraciones electrónicas más complejas.
Para ello, es útil recordar el orden de llenado de los subniveles: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, etc. Debemos tener en cuenta que algunos subniveles tienen una menor energía y se llenarán antes que otros.
Entonces, para calcular la configuración electrónica de un elemento, simplemente seguimos el orden de llenado y utilizamos la regla de Hund siempre que sea necesario. Recordemos que la regla de Hund nos dice que cada orbital se llenará con un electrón antes de llenarlo con dos.
Cabe destacar que esta regla se aplica a los elementos neutros en su estado fundamental y no tiene en cuenta las excepciones que pueden ocurrir en elementos ionizados o en estados excitados.
Estos son algunos de los temas que podría abordar en mi artículo sobre la regla de Hund.
La regla de Hund, también conocida como el principio de máxima multiplicidad, es un concepto en la química que explica el orden de llenado de los orbitales en los átomos y moléculas. Fue desarrollada por el físico alemán Friedrich Hund en 1925 y es fundamental para comprender la estructura electrónica de los elementos.
Orden de llenado de los orbitales
La regla de Hund establece que, cuando se llenan los orbitales de un subnivel, se debe dar preferencia al llenado de los orbitales con una mayor multiplicidad de espín, es decir, aquellos con el mismo valor del número cuántico de espín (ms).
Para entender el orden de llenado de los orbitales, es necesario utilizar el diagrama de Aufbau, que muestra la secuencia en la que los electrones se añaden a los diferentes subniveles de energía. La regla de Hund dicta que los electrones ocuparán los orbitales de un subnivel de manera que maximicen el número de electrones desapareados y, por lo tanto, maximicen la multiplicidad de espín.
Por ejemplo, consideremos el subnivel 2p. Este subnivel tiene tres orbitales (px, py y pz) y puede alojar un total de seis electrones. Según la regla de Hund, los electrones se colocarían inicialmente en cada uno de los tres orbitales antes de comenzar a aparearse.
Ejemplo de aplicación
Supongamos que queremos determinar el orden de llenado de los orbitales para el átomo de carbono. El carbono tiene seis electrones en total, por lo que comenzaríamos colocando un electrón en cada uno de los tres orbitales 2p (px, py y pz).
Después de que cada orbital tenga un electrón, aún nos quedan tres electrones restantes. Estos electrones se agregarían apareándolos en los orbitales ya ocupados, de acuerdo con el principio de mínima energía.
Es importante tener en cuenta que la regla de Hund solo se aplica al llenado de subniveles degenerados, es decir, aquellos que tienen el mismo valor de energía. Cuando hay subniveles con diferentes energías, como el subnivel 3d y el subnivel 4s en el elemento cromo, se debe tener en cuenta el principio de mínima energía para determinar el orden de llenado correspondiente.
La regla de Hund establece que, al llenar orbitales de igual energía, se deben colocar electrones con espines paralelos antes de emparejar electrones con espines opuestos.
El objetivo de la regla de Hund es minimizar la repulsión electrostática entre los electrones y estabilizar el estado del átomo o ion.
El orden de llenado de orbitales según la regla de Hund sigue la secuencia: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
La configuración electrónica siguiendo la regla de Hund se representa mediante flechas hacia arriba ↑ para indicar electrones con espines paralelos y flechas hacia abajo ↓ para indicar electrones con espines opuestos.
La importancia de la regla de Hund en la química radica en su papel fundamental para entender el comportamiento de los átomos y la formación de enlaces químicos. Esto se debe a que determina el orden de llenado de orbitales y la estabilidad de los estados electrónicos.
Deja una respuesta
Entradas relacionadas