Número de valencia: Descubre el secreto detrás de los enlaces químicos y domina la química
El número de valencia es un concepto fundamental en la química que nos ayuda a entender cómo se forman los enlaces entre átomos y, por lo tanto, cómo se crean las moléculas y compuestos químicos. Es la clave para comprender la reactividad y propiedades de las sustancias químicas, y juega un papel crucial en disciplinas como la bioquímica, la farmacología y la ciencia de materiales.
Exploraremos en detalle qué es el número de valencia y cómo se determina, así como su importancia en la formación de enlaces iónicos, covalentes y metálicos. Además, veremos ejemplos prácticos de cómo utilizar esta noción para predecir las propiedades de diferentes sustancias químicas y comprender su comportamiento en diversos contextos. Si deseas adentrarte en el fascinante mundo de la química y dominarla, comprender el número de valencia es un paso indispensable.
- Qué es el número de valencia en química y por qué es importante
- Cómo se determina el número de valencia de un elemento
- Cuál es la relación entre el número de valencia y la formación de enlaces químicos
- Cuáles son las reglas para determinar los números de valencia de los elementos más comunes
- Qué sucede cuando dos elementos con diferentes números de valencia se combinan para formar un compuesto
- Cuál es la importancia de entender el número de valencia al realizar predicciones sobre la reactividad de los elementos
- Cómo se representan los enlaces químicos en una fórmula estructural
- Cuál es la diferencia entre enlaces iónicos, covalentes y metálicos en términos del número de valencia
- Cómo ayuda el concepto de número de valencia a entender la formación de moléculas y compuestos
- ¿Cuáles son algunos ejemplos de elementos y compuestos cuyos números de valencia desempeñan un papel fundamental en sus propiedades y reacciones químicas?
- Si tienes alguna pregunta adicional o necesitas más información sobre el número de valencia y los enlaces químicos, no dudes en preguntar. ¡Estoy aquí para ayudarte a dominar la química!
Qué es el número de valencia en química y por qué es importante
En química, el número de valencia es una representación numérica que indica la capacidad de un átomo para formar enlaces químicos con otros átomos. También se conoce como número de oxidación o número de electrones de valencia.
El número de valencia determina cómo los átomos interactúan entre sí y qué tipo de enlace químico pueden formar. En otras palabras, nos da información sobre la estabilidad de un átomo y su tendencia a ganar, perder o compartir electrones.
Para entender mejor esto, debemos recordar que los electrones son partículas cargadas negativamente que giran alrededor del núcleo de un átomo. Los electrones de valencia son los que se encuentran en la capa más externa del átomo y están involucrados en las interacciones químicas.
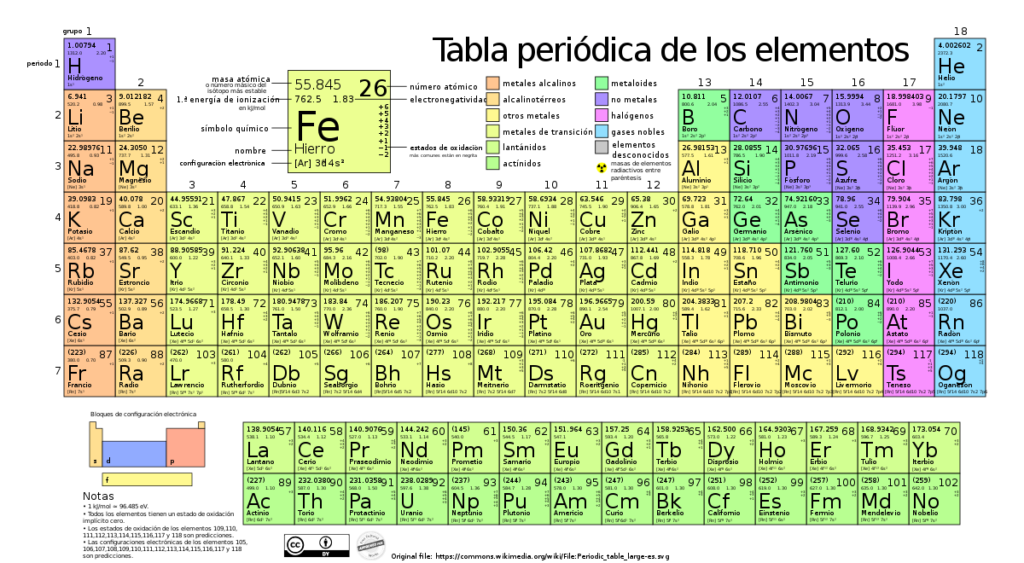
La cantidad de electrones de valencia de un átomo está relacionada con su posición en la tabla periódica. Generalmente, los átomos de los grupos 1 y 2 tienen uno y dos electrones de valencia respectivamente, mientras que los átomos de los grupos 13 al 18 tienen tres hasta ocho electrones de valencia.
Conociendo el número de valencia de un átomo, podemos predecir qué tipos de enlaces químicos se formarán cuando varios átomos se unen en una molécula. Por ejemplo, si un átomo tiene un número de valencia de uno, tiende a perder ese electrón para alcanzar una configuración estable con una capa exterior completa.
Por otro lado, si un átomo tiene un número de valencia alto, tiende a ganar electrones para completar su capa exterior. Estos átomos con alta electronegatividad pueden compartir electrones con otros átomos, formando enlaces covalentes.
El número de valencia es una herramienta fundamental para comprender cómo los átomos interactúan y se enlazan en la química. Su conocimiento nos permite predecir las propiedades y reactividad de los compuestos químicos, lo que resulta vital en el estudio de la química y en muchas otras áreas relacionadas con la ciencia y la tecnología.
Cómo se determina el número de valencia de un elemento
El número de valencia de un elemento se determina analizando su posición en la tabla periódica. El número de valencia de un átomo indica la cantidad de electrones que un átomo puede ganar, perder o compartir para alcanzar una configuración electrónica estable.
Para determinar el número de valencia de un elemento, primero debemos observar su grupo o columna en la tabla periódica. El número de grupo le indica al elemento cuántos electrones tiene en su nivel exterior, también conocido como capa de valencia.
Por ejemplo, el número de grupo del oxígeno es 16, lo que significa que tiene 6 electrones en su capa de valencia. Esto indica que el oxígeno tiene una valencia de 2, ya que necesita ganar dos electrones para alcanzar los 8 electrones en su capa de valencia y así tener una configuración electrónica estable similar a la del gas noble más cercano, el neón.
Sin embargo, hay excepciones a esta regla para algunos elementos de transición y elementos con propiedades particulares. Para estos casos, se recomienda consultar una tabla periódica más detallada que indique el número de valencia específico para cada elemento.
Conocer el número de valencia de un elemento es fundamental para comprender cómo se forman los enlaces químicos. Los elementos tienden a reaccionar con otros elementos para lograr una configuración electrónica estable y, en consecuencia, alcanzar un estado de menor energía.
En los enlaces químicos, los elementos pueden ganar, perder o compartir electrones para completar su capa de valencia y alcanzar una configuración electrónica estable. Por ejemplo, el sodio (Na) tiene una valencia de 1, lo que significa que tiende a perder este electrón para alcanzar una configuración similar a la del gas noble más cercano, el neón.
El número de valencia de un elemento se determina observando su posición en la tabla periódica y analizando el número de grupo o columna. Conocer el número de valencia es esencial para comprender cómo se forman los enlaces químicos y cómo los elementos reaccionan entre sí para lograr una configuración electrónica estable.
Cuál es la relación entre el número de valencia y la formación de enlaces químicos
El número de valencia es uno de los conceptos fundamentales en química, ya que juega un papel crucial en la formación de enlaces químicos. Para entender esta relación, primero debemos comprender qué es el número de valencia.
El número de valencia se refiere al número de electrones que un átomo puede ganar, perder o compartir para completar su capa de valencia y alcanzar una configuración electrónica estable. La capa de valencia es la capa más externa de electrones de un átomo y determina las propiedades químicas y la capacidad de formar enlaces.
La regla del octeto y el número de valencia
La mayoría de los átomos tienden a alcanzar la configuración electrónica estable de los gases nobles, que es una capa de valencia completa con 8 electrones. Esto se conoce como la regla del octeto. Los gases nobles son elementos especialmente estables y no reactivos debido a su capa de valencia completa, por lo que otros átomos tienden a buscar esa misma configuración para volverse estables.
El número de valencia nos indica cómo un átomo puede lograr la configuración de gas noble. Por ejemplo, un átomo de oxígeno tiene 6 electrones en su capa de valencia, por lo que necesita ganar 2 electrones adicionales para tener una capa completa con 8 electrones. Por lo tanto, el número de valencia del oxígeno es 2.
La importancia del número de valencia en la formación de enlaces químicos
El número de valencia es crucial en la formación de enlaces químicos, ya que permite a los átomos interactuar entre sí para compartir, ganar o perder electrones y alcanzar la estabilidad. Los enlaces químicos se forman cuando dos o más átomos comparten electrones para lograr completar su capa de valencia.
Por ejemplo, un átomo de hidrógeno tiene un solo electrón en su capa de valencia, por lo que necesita ganar 1 electrón adicional para tener una capa completa con 2 electrones. Mientras tanto, el átomo de cloro tiene 7 electrones en su capa de valencia y necesita ganar 1 electrón para alcanzar también la configuración del gas noble. Estos dos átomos pueden formar un enlace covalente compartiendo el par de electrones, de modo que ambos átomos logren su configuración de gas noble. En este caso, el número de valencia para ambos átomos es 1.
Además de los enlaces covalentes, también existen los enlaces iónicos, donde uno o más átomos transfieren electrones para lograr la estabilidad. El número de valencia también es crucial para determinar qué átomos tienen mayor facilidad para ganar o perder electrones en la formación de enlaces iónicos.
El número de valencia es esencial para entender cómo los átomos se unen y forman enlaces químicos. Nos proporciona información sobre la capacidad de los átomos para compartir, ganar o perder electrones y alcanzar una configuración electrónica estable. A través de los enlaces, los átomos pueden lograr la estabilidad y formar moléculas y compuestos químicos diversos.
Cuáles son las reglas para determinar los números de valencia de los elementos más comunes
Para determinar los números de valencia de los elementos más comunes, existen algunas reglas generales que debemos tener en cuenta. Estas reglas nos ayudarán a comprender cómo se forman los enlaces químicos y nos permitirán predecir las fórmulas y propiedades de los compuestos químicos.
Regla del octeto
La regla del octeto establece que la mayoría de los átomos tienden a adquirir una configuración electrónica similar a la de los gases nobles, es decir, ocho electrones en su última capa, para obtener máxima estabilidad. Esto se puede lograr ganando, perdiendo o compartiendo electrones con otros átomos. Por lo tanto, los números de valencia de los elementos más comunes suelen ser aquellos que les permiten alcanzar el octeto.
Números de oxidación
Los números de valencia también se conocen como números de oxidación. Son valores enteros que indican la capacidad de un átomo para perder o ganar electrones durante una reacción química. Para determinarlos, consideramos la posición del elemento en la tabla periódica, así como las siguientes pautas:
- Los gases nobles tienen números de valencia cero, ya que su configuración electrónica está completa y no necesitan ganar ni perder electrones.
- Los metales alcalinos (grupo 1) generalmente tienen número de valencia +1, ya que tienden a perder el único electrón de su capa externa.
- Los metales alcalinotérreos (grupo 2) suelen tener número de valencia +2, ya que tienden a perder los dos electrones de su capa externa.
- Los elementos del grupo 13 al grupo 18 suelen seguir la regla del octeto y tienen números de valencia acorde con su posición en la tabla periódica.
- Los no metales tienden a ganar electrones y, por lo tanto, sus números de valencia son negativos. El oxígeno, por ejemplo, tiene un número de valencia -2.
Es importante recordar que estas reglas son generalizaciones y pueden haber excepciones dependiendo del compuesto específico y las condiciones de la reacción química. También es posible encontrar elementos que puedan tener diferentes números de valencia, como el hierro, que puede presentar números de valencia +2 y +3.
Los números de valencia nos permiten entender cómo se forman los enlaces químicos y determinar la estabilidad de los compuestos. Siguiendo las reglas mencionadas anteriormente, podemos deducir los números de valencia de los elementos más comunes y anticipar la formación de enlaces químicos.
Qué sucede cuando dos elementos con diferentes números de valencia se combinan para formar un compuesto
El número de valencia es una propiedad clave de los elementos químicos que determina su capacidad para formar enlaces químicos. Cuando dos elementos con diferentes números de valencia se combinan, ocurren una serie de cambios y reacciones químicas que resultan en la formación de un compuesto.
En primer lugar, es importante comprender qué es el número de valencia. El número de valencia de un elemento indica la cantidad de electrones que puede ganar, perder o compartir para alcanzar la configuración electrónica estable de un gas noble. Los electrones de valencia son aquellos ubicados en el nivel de energía más externo de un átomo y son responsables de las interacciones químicas.
Cuando dos elementos con diferentes números de valencia se combinan, generalmente uno de los elementos perderá electrones mientras que el otro los ganará. Esto ocurre debido a que los elementos tienden a formar enlaces para alcanzar una configuración electrónica más estable.
Para ilustrar este proceso, tomemos como ejemplo la combinación del sodio (Na) y el cloro (Cl) para formar el compuesto cloruro de sodio (NaCl). El sodio tiene un número de valencia de 1, lo que significa que está dispuesto a perder un electrón para alcanzar la estabilidad electrónica del gas noble más cercano, el neón. Por otro lado, el cloro tiene un número de valencia de 7 y está dispuesto a ganar un electrón para alcanzar la estabilidad electrónica del gas noble más cercano, el argón.
En este caso, el sodio dona su electrón de valencia al cloro, formando así un enlace iónico. El sodio se convierte en un ion cargado positivamente, conocido como catión Na+, mientras que el cloro se convierte en un ion cargado negativamente, conocido como anión Cl-. Estos iones opuestos se atraen mutuamente debido a la interacción de las fuerzas electrostáticas, formando una red cristalina en la que cada ion está rodeado por iones de carga opuesta.
Cuando dos elementos con diferentes números de valencia se combinan, uno de los elementos perderá electrones, mientras que el otro los ganará. Este proceso resulta en la formación de un compuesto en el cual los átomos están unidos mediante enlaces químicos. El número de valencia es fundamental para comprender cómo ocurren estas combinaciones y reacciones químicas en el mundo de la química.
Cuál es la importancia de entender el número de valencia al realizar predicciones sobre la reactividad de los elementos
El número de valencia es un concepto fundamental en química que nos permite entender y predecir la reactividad de los elementos. La noción de número de valencia está relacionada con la cantidad de electroness que un átomo puede ganar, perder o compartir para completar su capa de valencia y alcanzar una configuración electrónica estable.
El conocimiento del número de valencia de un elemento es esencial para comprender cómo se forman los enlaces químicos y cómo los átomos interactúan entre sí. Los electrones de valencia son aquellos que están más alejados del núcleo y son los responsables de las propiedades químicas de un elemento. Por lo tanto, entender cómo se distribuyen estos electrones nos ayuda a predecir si un elemento tiende a ganar, perder o compartir electrones al interactuar con otros elementos.
Predicciones sobre la reactividad de los elementos
La reactividad química depende en gran medida del número de valencia de los elementos que participan en una reacción. Un elemento con un número de valencia bajo tenderá a perder electrones y convertirse en un ion positivo, mientras que un elemento con un número de valencia alto tenderá a ganar electrones y convertirse en un ion negativo.
Por ejemplo, el sodio (Na) tiene un número de valencia de 1, lo que significa que tiende a perder ese electrón para adquirir una configuración electrónica estable similar a la del gas noble más cercano, el neón. Al perder este electrón, el sodio se convierte en un ion Na+ y se vuelve altamente reactivo al buscar otros elementos con una afinidad electrónica alta, como el cloro (Cl), que tiene un número de valencia de 7. La pérdida y ganancia de electrones por parte del sodio y del cloro respectivamente da lugar a la formación del compuesto iónico conocido como cloruro de sodio (NaCl).
En contraste, los elementos con números de valencia similares tienden a compartir electrones para formar enlaces covalentes. Por ejemplo, el oxígeno (O) tiene un número de valencia de 6, lo que significa que necesita ganar dos electrones para alcanzar una configuración electrónica estable similar al gas noble más cercano, el neón. Sin embargo, en lugar de ganar estos dos electrones, el oxígeno comparte electrones con otros átomos de oxígeno en la formación de moléculas de dióxido de carbono (CO2).
El número de valencia es fundamental para predecir y comprender la reactividad de los elementos. Nos permite determinar si un elemento tiende a perder, ganar o compartir electrones al interactuar con otros elementos, y nos proporciona información sobre la formación de enlaces químicos tanto iónicos como covalentes. Por lo tanto, tener un sólido entendimiento del número de valencia es esencial para dominar la química y comprender cómo se forman y transforman las sustancias químicas.
Cómo se representan los enlaces químicos en una fórmula estructural
Los enlaces químicos se representan de manera visual en una fórmula estructural. Esta es una forma de mostrar la configuración precisa de los átomos y cómo se conectan entre sí para formar una molécula.
En una fórmula estructural, cada átomo se representa por su símbolo químico y se colocan en el orden en que están dispuestos en la molécula. Los enlaces químicos se muestran utilizando líneas que unen los átomos.
Existen diferentes tipos de enlaces químicos que se pueden representar en una fórmula estructural. Algunos de los más comunes son:
- Enlace covalente: se representa con una línea recta que une dos átomos. Este tipo de enlace ocurre cuando los átomos comparten electrones para completar su configuración electrónica.
- Enlace iónico: se representa mediante una línea discontinua que muestra la transferencia de electrones entre los átomos. En este tipo de enlace, un átomo dona electrones para formar un catión positivo y otro átomo acepta esos electrones para formar un anión negativo.
- Enlace metálico: se representa con una línea ondulada que indica una nube electrónica en la que los electrones se comparten entre todos los átomos del metal. Este tipo de enlace es típico en los metales y les da sus propiedades únicas, como la conductividad eléctrica y térmica.
Además de mostrar los enlaces químicos, una fórmula estructural también puede incluir información sobre la geometría de la molécula. Esto se representa utilizando diferentes notaciones y símbolos para indicar los ángulos y distancias entre los átomos.
Es importante destacar que las fórmulas estructurales son una representación simplificada de las moléculas reales. No muestran la verdadera forma tridimensional de la molécula ni la ubicación precisa de los electrones. Sin embargo, son una herramienta útil para comprender y visualizar cómo se forman los enlaces químicos.
Cuál es la diferencia entre enlaces iónicos, covalentes y metálicos en términos del número de valencia
La química es una disciplina fascinante que estudia la estructura y las propiedades de la materia, así como las interacciones entre átomos y moléculas. Uno de los conceptos fundamentales en química es el número de valencia, que juega un papel crucial en la formación de enlaces químicos.
El número de valencia se refiere al número de electrones que un átomo necesita ganar, perder o compartir para alcanzar la configuración electrónica estable de un gas noble. Los gases nobles tienen una configuración electrónica completa en su capa de valencia, lo que los hace altamente estables y poco reactivos. Los demás elementos químicos buscan “imitar” esta configuración mediante la formación de enlaces químicos.
Enlaces iónicos
Los enlaces iónicos se forman cuando hay una transferencia de electrones entre un metal y un no metal. El metal pierde electrones de su capa de valencia para convertirse en un catión, mientras que el no metal gana electrones para convertirse en un anión. Esta transferencia de electrones da lugar a la formación de iones cargados eléctricamente, que se atraen mutuamente debido a sus cargas opuestas. Estos iones se organizan en una disposición regular llamada red cristalina.
Por ejemplo, en el compuesto NaCl (cloruro de sodio), el sodio (Na) pierde su único electrón de valencia y se convierte en un catión con carga positiva (Na+), mientras que el cloro (Cl) gana ese electrón para alcanzar una configuración estable y se convierte en un anión con carga negativa (Cl-). Los iones Na+ y Cl- se atraen fuertemente entre sí formando una red cristalina de cloruro de sodio.
Enlaces covalentes
Los enlaces covalentes ocurren cuando dos átomos comparten electrones en su capa de valencia. Esto sucede principalmente entre los no metales, ya que tienden a tener una alta electronegatividad y tienen la tendencia de ganar o compartir electrones para alcanzar la estabilidad.
Por ejemplo, el enlace covalente entre dos átomos de oxígeno en la molécula de oxígeno (O2) se forma cuando cada átomo aporta dos electrones de su capa de valencia, formando así una nube electrónica compartida. Esta nube electrónica compartida mantiene a los dos átomos unidos y crea un enlace covalente fuerte y estable.
Enlaces metálicos
Los enlaces metálicos son característicos de los metales y se forman cuando los átomos metálicos comparten sus electrones de valencia de manera uniforme en una "nube" de electrones móviles. Esto da lugar a una estructura de red metálica, donde los núcleos positivamente cargados están inmersos en esta nube de electrones móviles.
Los electrones de valencia en un metal no están firmemente ligados a un solo átomo, sino que están "libres" para moverse dentro de la estructura cristalina. Esto confiere a los metales propiedades únicas, como la maleabilidad y la conductividad eléctrica.
El número de valencia es fundamental para comprender los enlaces químicos. Los enlaces iónicos ocurren cuando hay una transferencia de electrones entre un metal y un no metal, los enlaces covalentes se forman mediante el intercambio de electrones entre dos no metales y los enlaces metálicos se caracterizan por una nube de electrones móviles compartidos por átomos metálicos.
Cómo ayuda el concepto de número de valencia a entender la formación de moléculas y compuestos
El número de valencia es un concepto fundamental en la química que nos ayuda a entender cómo se forman los enlaces químicos y cómo se combinan los átomos para formar moléculas y compuestos. Representa la cantidad de electrones que un átomo puede ganar, perder o compartir para completar su configuración electrónica y alcanzar una mayor estabilidad.
El número de valencia se basa en el modelo del octeto, que establece que los átomos tienden a adquirir o perder electrones para alcanzar una configuración electrónica similar a la de los gases nobles, que son altamente estables y no reactivos debido a su configuración electrónica completa. En general, los átomos buscan tener 8 electrones en su capa de valencia para lograr esta estabilidad.
¿Cómo determinar el número de valencia de un átomo?
Para determinar el número de valencia de un átomo, debemos observar su posición en la tabla periódica. En general, podemos utilizar el número de grupo (columna) en el que se encuentra el elemento para determinar su número de valencia. Por ejemplo, los elementos del grupo 1 tienen un número de valencia de 1, ya que tienden a perder un solo electrón para alcanzar la configuración de gas noble más cercana. De manera similar, los elementos del grupo 2 tienen un número de valencia de 2, los del grupo 13 tienen un número de valencia de 3, y así sucesivamente.
Existen algunas excepciones a esta regla general, como las transiciones internas, los lantánidos y actínidos, que tienen configuraciones electrónicas más complejas y pueden tener diferentes números de valencia.
¿Cómo se utilizan los números de valencia para formar enlaces químicos?
Los átomos tienden a perder o ganar electrones para igualar el número de valencia de los gases nobles más cercanos. Por ejemplo, un átomo de sodio (Na) tiene un número de valencia igual a 1, mientras que un átomo de cloro (Cl) tiene un número de valencia igual a 7. Para alcanzar una configuración de gas noble, el átomo de sodio tiende a perder su único electrón de valencia, mientras que el átomo de cloro tiende a ganar un electrón para completar su capa de valencia con 8 electrones.
En este caso, se forma un enlace iónico entre el sodio y el cloro, donde el sodio dona su electrón al cloro. Esto resulta en la formación de iones cargados, donde el sodio se convierte en un catión con carga positiva (Na+) y el cloro se convierte en un anión con carga negativa (Cl-). La atracción electrostática entre estos iones es lo que mantiene unidos a los compuestos iónicos, como el cloruro de sodio (NaCl).
En otros casos, los átomos pueden compartir electrones para alcanzar la estabilidad. Esto ocurre en enlaces covalentes, donde dos átomos comparten pares de electrones. El número de pares de electrones compartidos entre dos átomos determina la naturaleza y la fuerza del enlace. Los átomos que comparten electrones de esta manera se combinan para formar moléculas, como en el caso del agua (H2O) donde el oxígeno comparte dos pares de electrones con dos átomos de hidrógeno.
Entender el número de valencia nos permite comprender cómo los átomos se combinan para formar enlaces químicos y cómo estos enlaces dan lugar a la formación de moléculas y compuestos. El concepto de número de valencia es fundamental para dominar la química y comprender la estructura y las propiedades de las sustancias químicas.
¿Cuáles son algunos ejemplos de elementos y compuestos cuyos números de valencia desempeñan un papel fundamental en sus propiedades y reacciones químicas?
Los números de valencia son fundamentales para comprender las propiedades y reacciones químicas de diversos elementos y compuestos. A continuación, te presento algunos ejemplos donde el número de valencia desempeña un papel fundamental:
1. Hidrógeno (H)
El hidrógeno es un elemento con un número de valencia de 1. Esto significa que puede formar un solo enlace covalente al compartir un electrón con otro elemento. Por ejemplo, en el agua (H2O), cada átomo de hidrógeno se enlaza con el átomo de oxígeno mediante un enlace covalente, lo que resulta en la molécula de agua.
2. Oxígeno (O)
El oxígeno tiene un número de valencia de 2. Esto significa que puede formar dos enlaces covalentes al compartir electrones con otros elementos. Un ejemplo importante es el dióxido de carbono (CO2), donde cada átomo de oxígeno se enlaza con el átomo de carbono mediante un enlace doble covalente, lo que da lugar a la molécula de dióxido de carbono.
3. Carbono (C)
El carbono tiene un número de valencia de 4. Esto significa que puede formar hasta cuatro enlaces covalentes con otros átomos. Un ejemplo icónico es el metano (CH4), donde el átomo de carbono se enlaza con cuatro átomos de hidrógeno mediante enlaces covalentes sencillos.
4. Sodio (Na) y Cloro (Cl)
El sodio tiene un número de valencia de 1, mientras que el cloro tiene un número de valencia de 7. Esto los convierte en una combinación perfecta para la formación de cloruro de sodio (NaCl), también conocido como sal de mesa. En esta molécula, el átomo de sodio dona su electrón de valencia al átomo de cloro, lo que resulta en un enlace iónico fuerte. Esta interacción entre los números de valencia de ambos elementos es clave para la formación del compuesto y define muchas propiedades del mismo.
Estos son solo algunos ejemplos de cómo el número de valencia de los elementos y compuestos desempeña un papel fundamental en sus propiedades y reacciones químicas. Comprender estos números nos permite predecir la forma en que los átomos se combinan y cómo las moléculas interactúan entre sí.
Si tienes alguna pregunta adicional o necesitas más información sobre el número de valencia y los enlaces químicos, no dudes en preguntar. ¡Estoy aquí para ayudarte a dominar la química!
¿Qué es el número de valencia?
El número de valencia es una propiedad química que determina la capacidad de un átomo para formar enlaces con otros átomos. Es la cantidad de electrones que un átomo puede compartir, donar o recibir para completar su configuración electrónica y alcanzar la estabilidad.
Importancia del número de valencia
El número de valencia es crucial para entender cómo se forman los enlaces químicos entre átomos. Nos permite predecir el tipo de enlace que se formará (iónico, covalente o metálico) y las propiedades físicas y químicas de las sustancias resultantes.
Determinando el número de valencia
Para determinar el número de valencia de un elemento, generalmente se mira el grupo o familia a la que pertenece en la tabla periódica. Los elementos en el mismo grupo tienen propiedades químicas similares y, por lo general, tienen el mismo número de valencia.
Algunos elementos tienen números de valencia fijos, como los elementos del grupo 1 (metales alcalinos) que siempre tienen una valencia de +1, y los elementos del grupo 2 (metales alcalinotérreos) que siempre tienen una valencia de +2.
En otros casos, el número de valencia puede variar dependiendo de la estructura química y las condiciones específicas. Por ejemplo, el carbono tiene una valencia de 4 en los hidrocarburos, pero puede tener valencias menores en compuestos como el dióxido de carbono.
Ejemplos de número de valencia
Algunos ejemplos comunes de números de valencia son:
- Sodio (Na): Valencia +1
- Oxígeno (O): Valencia -2
- Nitrógeno (N): Valencia -3
- Carbono (C): Valencia 4
- Calcio (Ca): Valencia +2
- Hidrógeno (H): Valencia +1 o -1, dependiendo del compuesto
Estos son solo algunos ejemplos, y hay muchos otros elementos con diferentes números de valencia.
Enlaces químicos y número de valencia
El número de valencia es fundamental para la formación de enlaces químicos. En un enlace iónico, los átomos con valencias opuestas se atraen eléctricamente y se unen mediante la transferencia de electrones.
En un enlace covalente, los átomos comparten uno o más pares de electrones para completar sus capas exteriores y alcanzar la estabilidad. Aquí, el número y tipo de enlaces covalentes que un átomo puede formar están determinados por su número de valencia.
El número de valencia es una propiedad crucial para entender cómo los átomos interactúan entre sí para formar compuestos químicos. Al dominar esta concepción, podrás comprender mejor los enlaces químicos y tener una base sólida en química.
El número de valencia es la cantidad de electrones que un átomo puede compartir, perder o ganar para formar enlaces químicos.
El número de valencia se puede determinar a partir del grupo en el que se encuentra un elemento en la tabla periódica.
Conocer el número de valencia de un elemento nos permite predecir cómo se va a combinar con otros elementos para formar compuestos químicos.
El máximo número de valencia que un átomo puede tener es 8, excepto para el hidrógeno y el helio que solo pueden tener 2.
El número de valencia se representa generalmente como un superíndice a la derecha del símbolo del elemento, por ejemplo, el oxígeno tiene un número de valencia de -2 y se representa como O^-2.
Deja una respuesta
Entradas relacionadas